1
MEMBRANA CITOPLÁSMICA
1.1
COMPOSICIÓN QUÍMICA
La membrana citoplásmica bacteriana es la estructura de tipo bicapa
proteo-lipídica que delimita al protoplasto. Su proporción proteínas: lípidos
es superior a la de las membranas celulares eucarióticas, llegando a alcanzar
valores relativos de 80:20.
1.1.1
CARENCIA, EN GENERAL, DE ESTEROLES
Las membranas procarióticas, a diferencia de las de eucariotas, carecen
de esteroles (con las salvedades de Cianobacterias, ciertas bacterias
metilotrofas; además, los micoplasmas presentan colesterol, pero lo
“secuestran” de las células eucarióticas a las que parasitan).
Pero en cambio, en muchas bacterias existe una peculiar clase de
compuestos policíclicos, denominados hopanoides (triterpenoides
pentacíclicos) que parecen condicionar parte de la rigidez de las membranas
citoplásmicas. Los hopanoides se sintetizan a partir del mismo tipo de
precursores que los esteroles. (Por cierto, como dato curioso diremos que los
sedimentos de combustibles fósiles como el petróleo presentan cantidades
gigantescas de hopanoides, lo que confirma el papel que tuvieron las bacterias
en su formación).
1.1.2
LÍPIDOS
Abundan
sobre todo los fosfolípidos
derivados del ácido fosfatídico:
sobre todo los fosfolípidos
derivados del ácido fosfatídico:
fosfatidiletanolamina | |
fosfatidilglicerol | |
cardiolipina (difosfatidilglicerol) |
En bacterias Gram-positivas, además
se encuentran glucolípidos
y glucofosfolípidos.
se encuentran glucolípidos
y glucofosfolípidos.
La composición y proporción concretas de los distintos tipos de lípidos
son variables entre distintas cepas bacterianas, y dentro de cada cepa, en función
de las condiciones de cultivo (temperatura, pH, etc.).
Los ácidos grasos esterificados con
el glicerol en los fosfolípidos son principalmente:
el glicerol en los fosfolípidos son principalmente:
1)
saturados, como p. ej.:
saturados, como p. ej.:
a)
palmítico (16:0)
palmítico (16:0)
b)
mirístico (14:0)
mirístico (14:0)
c)
de cadena ramificada (muy frecuentes en muchas bacterias Gram-positivas)
de cadena ramificada (muy frecuentes en muchas bacterias Gram-positivas)
2)
monoinsaturados (sobre todo en Gram-negativas), como p. ej.:
monoinsaturados (sobre todo en Gram-negativas), como p. ej.:
a)
palmitoleico (cis-9, 16:1)
palmitoleico (cis-9, 16:1)
b)
cis-vaccénico (cis-11, 18:1)
cis-vaccénico (cis-11, 18:1)
A diferencia de eucariotas, no existen ácidos grasos poliinsaturados,
con la excepción de las Cianobacterias. Este grupo de bacterias fotosintéticas
tiene, además, la capacidad de modificar mediante desaturasas el grado de
saturación de sus ácidos grasos, lo que representa un mecanismo adaptativo
frente a cambios de temperatura.
Las bacterias pueden
modificar la proporción entre ácidos grasos insaturados y saturados,
con objeto de mantener un estado de fluidez adecuado en la membrana, como
adaptación a cambios de temperatura:
a altas temperaturas, aumenta la proporción de ácidos grasos saturados, | |
a bajas, aumenta la de los insaturados. Las bacterias psicrófilas (amantes del frío) presentan casi todos sus ácidos grasos de tipo insaturado. |
En Arqueas, en lugar de los habituales lípidos
a base de ésteres de ácidos grasos con glicerol, existen lípidos
a base de éteres de alcoholes de cadena larga con glicerol (p. ej., difitanil-glicerol-diéteres). Los alcoholes
suelen ser derivados poliisoprenoides. Este tipo de membranas son más rígidas
que las de eubacterias. Incluso existen arqueas con membranas a partir de
tetrafitanil-diglicerol-tetraétereres, que consituyen bicapas monomoleculares.
Como ya vimos en el tema anterior, la membrana citoplásmica alberga un
transportador lipídico de tipo politerpenoide, llamado undecaprenil-fosfato,
presente en pequeña cantidad (<1%). Igualmente se dan quinonas isoprenoides (como la
menaquinona o la ubiquinona) que, como veremos en otro capítulo, participan en
cadenas de transporte de electrones. En algunas bacterias existen igualmente
variedades de pigmentos
carotenoides.
1.1.3
PROTEÍNAS
Constituyen la mayor parte de la membrana bacteriana (hasta el 80% en
peso seco). Existe una gran variedad de tipos de proteínas en una misma
bacteria (hasta 200), pero la composición y proporción concreta varía según
las condiciones de cultivo.
Según su localización en la membrana, y su grado de unión con la porción
lipídica, se distingue entre:
proteínas integrales de membrana (=endoproteínas): son proteínas estrechamente unidas a la membrana, por lo general atravesadas en plena bicapa lipídica. Son difíciles de extraer, teniéndose que recurrir a detergentes y/o disolventes orgánicos para separarlas respecto de los lípidos. Las proteínas integrales pueden desplazarse lateralmente en la bicapa lipídica, pero no son capaces de rotar, por lo que siempre presentan una determinada orientación o polaridad. Algunas presentan hidratos de carbono que sobresalen hacia la superficie externa (glucoproteínas). | |
Proteínas periféricas (= epiproteínas): unidas a la superficie de la membrana, de forma más débil, por lo que son más fáciles de extraer y purificar. Incluso algunas establecen contactos sólo transitorios con la membrana. |
 |
1.2
ESTRUCTURA
Métodos
de observación y estudio
de observación y estudio
A microscopio óptico, se recurre a la tinción con Azul Victoria. A
microscopio electrónico, en cortes ultrafinos, se observan una estructura de
unos 7 nm de grosor, con dos capas externas densas a los electrones limitando
una capa central transparente.
Los estudios mediante difracción de rayos X y de resonancia magnética
nuclear (RMN) demuestran una estructuración básica a base de cadenas de fosfolípidos
en una bicapa, según se describe a continuación.
Estructura
Consiste en una bicapa lipídica, con los grupos polares (hidrófilos)
hacia afuera, y las cadenas hidrofóbicas de ácidos grasos (o, en el caso de
Arqueobacterias, de alcoholes) hacia adentro, ajustándose al modelo de mosaico
fluido de Singer y Nicholson. Inmersas en esta bicapa se encuentran las
abundantes proteínas, que pueden moverse lateralmente en el mosaico de moléculas
de lípidos, igualmente dotados de una rápida movilidad. Parece ser que no
existe movilidad de lípidos entre las dos capas.
La membrana citoplásmica es asimétrica (aunque no tanto como la
membrana externa de Gram-negativas). Esto se traduce en el hecho de que muchos
de los procesos que tienen lugar en la membrana sean vectoriales
(tengan una dirección determinada).
1.3
FUNCIONES DE LA MEMBRANA CITOPLASMICA
La membrana citoplásmica de los procariotas es una notable estructura
multifuncional (como uno podría esperar de la constatación del gran número de
tipos de proteínas), siendo el sitio donde se producen muchos procesos metabólicos
complejos, en un grado desconocido en el resto del mundo vivo.
Citemos brevemente las principales
funciones de la membrana procariótica (aunque en este y otros temas las
estudiaremos en detalle):
funciones de la membrana procariótica (aunque en este y otros temas las
estudiaremos en detalle):
Barrera osmótica (que mantiene constante el medio interno), impidiendo el paso libre de sales y de compuestos orgánicos polares | |
Es el límite metabólicamente activo de la célula: establece la frontera entre el protoplasto y el medio externo, impidiendo la pérdida de metabolitos y macromoléculas del protoplasto. | |
Ahora bien, merced a sistemas de transporte, permite selectivamente el paso de sustancias entre el exterior y el interior (y viceversa). | |
Interviene, además, en procesos bioenergéticos (fotosíntesis, respiración) | |
Participa en la biosíntesis de componentes de membrana, de pared y de cápsulas, | |
En la secreción de proteínas. |
Desglosaremos
brevemente estos diversos tipos de papeles de la membrana.
brevemente estos diversos tipos de papeles de la membrana.
1.3.1
PARTICIPACIÓN EN PROCESOS BIOENERGÉTICOS
Contiene todos los componentes requeridos para la transducción de energía
y la producción de ATP, por procesos respiratorios. En el caso de una bacteria
quimiotrofa, esto incluye:
deshidrogenasas | |
cadenas de transporte de electrones (con quinonas, citocromos, etc.) | |
ATP-asas (ATP sintasas/hidrolasas) |
Algunas bacterias fotosintéticas
anaerobias también incluyen este tipo de componentes en la membrana citoplásmica.
anaerobias también incluyen este tipo de componentes en la membrana citoplásmica.
En un capítulo posterior veremos en más detalle cómo explica la teoría
quimiosmótica de Mitchell el acoplamiento entre el funcionamiento de las
cadenas de transporte electrónico (o de la ATP-hidrolasa) y la generación de
un gradiente de protones a través de la membrana (potencial electroquímico o
fuerza protón-motriz), el cual a su vez puede:
generar ATP (desarrollo de un trabajo químico) | |
promover transporte de ciertos nutrientes (trabajo osmótico) | |
promover movimiento flagelar (trabajo mecánico). |
1.3.2
PARTICIPACIÓN EN BIOSÍNTESIS DE POLÍMEROS DE LAS ENVUETAS
Como ya hemos visto en temas anteriores, la membrana alberga
transportadores (como el undecaprenil-P) y enzimas relacionados con fases de la
biosíntesis de polisacáridos de la cápsula, peptidoglucano, ácidos teicoicos
y teicurónicos y lipopolisacárido. Igualmente en ella se localizan los enzimas
implicados en la síntesis de los lípidos de la propia membrana.
1.3.3
PUNTO DE ANCLAJE DEL CROMOSOMA Y DE ALGUNOS PLÁSMIDOS
Como veremos, sigue estando debatido si un tipo de invaginación de la
membrana, llamado mesosoma (ver más adelante, en este capítulo, apartado 3.1)
es o no un artefacto, pero parece fuera de duda que el cromosoma se ancla de
alguna manera a la cara interna de la membrana (sea a los mesosomas, o como
proponen otros, a la cara interna de los anillos perisépticos). En la zona de
anclaje parecen residir algunos de los enzimas encargado de la replicación. La
membrana tiene igualmente un papel en la separación (segregación) de las dos
copias del cromosoma replicado a las células hijas.
1.3.4
BARRERA SELECTIVA
Mantiene la constancia del medio interno (impidiendo la salida de iones,
metabolitos y macromoléculas), pero simultáneamente permite
o promueve activamente la entrada de nutrientes y la salida de los productos de
desecho o de ciertas moléculas excretadas. La función de transporte
de nutrientes será tratada en detalle más adelante en este capítulo.
1.3.5
EXPORTACIÓN DE MOLÉCULAS DE SUPERFICIE
Se trata de un sistema por el que
ciertas proteínas son trasladadas a su localización definitiva en la membrana
citoplásmica, por la intervención de la proteína YidC, que interacciona con
zonas hidrofóbicas de aquellas. Un ejemplo de proteínas insertadas de este modo
lo constituye la ATP-sintasa de eubacterias. Este sistema, al parecer
filogenéticamente primitivo, aparece en eubacterias, parte de arqueas (euriarqueas)
y en mitocondrias (donde se denomina Oxa1) y cloroplastos (Alb3), pero no en
eucariotas.
ciertas proteínas son trasladadas a su localización definitiva en la membrana
citoplásmica, por la intervención de la proteína YidC, que interacciona con
zonas hidrofóbicas de aquellas. Un ejemplo de proteínas insertadas de este modo
lo constituye la ATP-sintasa de eubacterias. Este sistema, al parecer
filogenéticamente primitivo, aparece en eubacterias, parte de arqueas (euriarqueas)
y en mitocondrias (donde se denomina Oxa1) y cloroplastos (Alb3), pero no en
eucariotas.
2) SISTEMA Sec
El sistema Sec es un sistema universal
para la secreción de proteínas, es decir, aparece en los tres dominios de la
vida, aunque con variantes en cada uno de ellos. Nosotros vamos a describir el
caso de las eubacterias.
para la secreción de proteínas, es decir, aparece en los tres dominios de la
vida, aunque con variantes en cada uno de ellos. Nosotros vamos a describir el
caso de las eubacterias.
Las proteínas secretadas se sintetizan como pre-proteínas dotadas en el extremo N-terminal de un péptido señal, de unos 20-30 aminoácidos. Dicha zona consta a su vez de un extremo N-terminal cargado positivamente, seguida de un trecho hidrofóbico, y termina con una zona más polar dotada al final del sitio que va a ser roto por la peptidasa del líder. | |
Cuando aún está en el citoplasma, la pre-proteína naciente se une a la proteína SecB (una chaperona específica de esta ruta), la cual impide que la pre-proteína se pliegue totalmente. | |
La proteína SecA, que forma un homodímero, reconoce el complejo SecB-preproteína, y lo traslada al complejo de proteínas de membrana SecYEG, que tiene un canal interior de unos 20-30 Å. (Al parecer el canal consta de 3-4 complejos SecYEG). | |
Ahora, la proteína SecA, con gasto de ATP, logra que los primeros 20-30 aminoácidos de la pre-proteína entren a través del canal Sec, con lo que el péptido señal aparece por el lado exterior de la membrana. | |
Una vez que el péptido señal asoma por el otro lado de la membrana, es cortado en el sitio específico por la peptidasa líder, lo que ayuda a liberar al exterior la parte madura de la proteína secretada. |
3) SISTEMA SRP
El sistema SRP procariótico es mucho
más sencillo que el homólogo SRP que se encuentra en la membrana del retículo
endoplásmico de eucariotas. En este sistema, el extremo N-terminal de la
proteína naciente es reconocido por la partícula de reconocimiento de señal,
conocida por sus siglas SRP.
más sencillo que el homólogo SRP que se encuentra en la membrana del retículo
endoplásmico de eucariotas. En este sistema, el extremo N-terminal de la
proteína naciente es reconocido por la partícula de reconocimiento de señal,
conocida por sus siglas SRP.
La SRP eubacteriana consta de un pequeño ARN y una proteína (Ffh). | |
Una vez que la SRP reconoce el extremo N-terminal de la proteína naciente, parece que provoca la detención momentánea de la traducción, y conduce a esa proteína naciente hasta el receptor de la partícula SRP (SR), a nivel de membrana citoplásmica. | |
A su vez esto provoca la interacción del péptido naciente con el complejo Sec, que será el que logre la secreción o inserción en membrana de la proteína madura. |
4) SISTEMA Tat
Este sistema se ha empezado a
caracterizar recientemente, y solo se ha descubierto en procariotas y en
cloroplastos, pero no en mitocondrias ni en eucariotas. Se caracteriza por
trasladar al exterior (o al espacio periplásmico de Gram-negativas) proteínas
ya en su configuración nativa, y en su caso, dotadas ya de sus cofactores
(grupos FeS, molibdopterina, cofactores nucleotídicos, etc.). Es decir, a
diferencia de los anteriores, las proteínas se pliegan /y en su caso adquieren
los cofactores) antes de ser trasladadas. Este sistema se llama Tat debido a que
reconoce una secuencia señal en la que existen dos argininas “gemelas” (una a
continuación de otra, “twin arginine transport”). Consta de al menos tres
tipos de proteínas de membrana: TatA, TatB y TatC. Varias unidades de TatA
atraviesan la membrana formando una empalizada que deja un gran canal de unos 60
Å. Cómo se logra el transporte a través de este gran agujero en la membrana sin
que se pierda su capacidad de barrera selectiva es una “hazaña” que se está
investigando.
caracterizar recientemente, y solo se ha descubierto en procariotas y en
cloroplastos, pero no en mitocondrias ni en eucariotas. Se caracteriza por
trasladar al exterior (o al espacio periplásmico de Gram-negativas) proteínas
ya en su configuración nativa, y en su caso, dotadas ya de sus cofactores
(grupos FeS, molibdopterina, cofactores nucleotídicos, etc.). Es decir, a
diferencia de los anteriores, las proteínas se pliegan /y en su caso adquieren
los cofactores) antes de ser trasladadas. Este sistema se llama Tat debido a que
reconoce una secuencia señal en la que existen dos argininas “gemelas” (una a
continuación de otra, “twin arginine transport”). Consta de al menos tres
tipos de proteínas de membrana: TatA, TatB y TatC. Varias unidades de TatA
atraviesan la membrana formando una empalizada que deja un gran canal de unos 60
Å. Cómo se logra el transporte a través de este gran agujero en la membrana sin
que se pierda su capacidad de barrera selectiva es una “hazaña” que se está
investigando.
2
TRANSPORTE DE NUTRIENTES
Lo primero que tiene que hacer un microorganismo a la hora de su nutrición
es captar los nutrientes que necesite desde el medio exterior. Debido a que la
bicapapa lipídica actúa como barrera que impide el paso de la mayor parte de
las sustancias, esto significa que deben existir mecanismos específicos para
lograr la entrada de los nutrientes. Además, teniendo en cuenta que las
bacterias suelen vivir en medios diluidos, deben realizar un “trabajo” para
trasladar muchos de esos nutrientes en contra del gradiente de concentración.
Tradicionalmente se viene considerando tres métodos principales de
transporte de sustancias a través de la membrana:
transporte pasivo inespecífico (= difusión simple); | |
transporte pasivo específico (= difusión facilitada); | |
transporte activo. |
Como veremos, los más
importantes en procariotas son los sistemas de transporte activo.
importantes en procariotas son los sistemas de transporte activo.
2.1
TRANSPORTE PASIVO INESPECÍFICO O DIFUSIÓN SIMPLE
Este transporte consiste en la difusión pasiva de ciertas sustancias
para las que la membrana es impermeable, debido a la diferencia de concentración
(DC)
a ambos lados de dicha membrana (la sustancia tiene mayor concentración fuera
que dentro de la célula). Aparte de esta diferencia de concentración, en la
difusión pasiva influyen:
la constante de permeabilidad (P), es decir, el grado de permeabilidad de la membrana a la sustancia en cuestión; | |
el área o superficie total (A) a través de la que se produce el transporte. |
Las membranas citoplásmicas son impermeables en sí mismas a la mayor
parte de las moléculas. Sólo se da en el caso de O2, CO2,
NH3, agua y otras pequeñas sustancias polares no ionizadas.
La difusión simple se produce por el paso de estas sustancias a través
de poros inespecíficos de la membrana citoplásmica.
2.2
TRANSPORTE PASIVO ESPECÍFICO O DIFUSIÓN FACILITADA
Es un proceso que permite el paso de compuestos por difusión a través
de transportadores estereoespecíficos y (al igual que en el caso anterior)
sobre la base de un gradiente de concentración (en la dirección termodinámicamente
favorable).
El transportador suele ser una proteína integral de membrana (permeasa o facilitador), cuya
conformación determina un canal interior, y por el cual un determinado sustrato
puede alcanzar el interior, sin gasto de energía. Se piensa que cuando el
soluto se une a la parte de la permeasa que da al exterior, esta proteína sufre
un cambio conformacional que libera la molécula en el interior. Como al entrar
la molécula, enseguida entra en el metabolismo y desaparece como tal, esto
basta para mantener el gradiente de concentración que permite esta difusión.
La difusión facilitada exhibe propiedades similares a las de las reacciones
enzimáticas:
Especificidad de sustrato: cada permeasa transporte un solo tipo de sustratos químicamente parecidos. | |
Cinética de saturación de tipo Michaelis-Menten, es decir, la velocidad de transporte aumenta con la concentración de sustrato, hasta un valor límite (Vmax) por encima del cual ulteriores aumentos del soluto no aumentan dicha velocidad (debido a que todas las porinas disponibles están ya totalmente ocupadas): |
Velocidad
de entrada: Vent = Vmáx
· [Sext] /Km
+ [Sext]
de entrada: Vent = Vmáx
· [Sext] /Km
+ [Sext]
Velocidad
de salida: Vsal
= Vmáx · [Sint]
/Km + [Sint]
de salida: Vsal
= Vmáx · [Sint]
/Km + [Sint]
Aunque este sistema de transporte es muy común en eucariotas, es muy
raro encontrarlo en bacterias. La explicación evolutiva es que los procariotas
suelen vivir en ambientes con pocas concentraciones de nutrientes, y por lo
tanto no es frecuente que se den gradientes adecuados. Una de las pocas
excepciones la constituye el glicerol, que es transportado por difusión
facilitada en una amplia gama de bacterias, tanto Gram-positivas como
Gram-negativas. Conforme el glicerol entra, es rápidamente convertido a
glicerol-fosfato; por lo tanto, la concentración interna de glicerol como tal
es prácticamente nula, lo que facilita esta difusión incluso a bajas
concentraciones exteriores de esta sustancia. En Zymomonas
existe un facilitador de membrana que transporta glucosa.
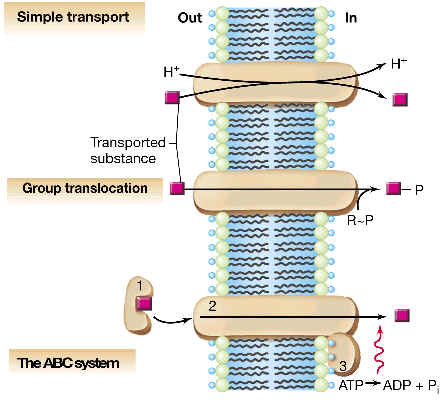
2.3
TRANSPORTE ACTIVO
Consiste en el transporte de sustancias en
contra de un gradiente de concentración, lo que requiere un gasto energético. En la mayor parte de
los casos este transporte activo (que supone un trabajo osmótico) se realiza
a expensas de un gradiente de H+ (potencial electroquímico de protones) previamente creado a ambos lados de la membrana, por procesos de respiración y fotosíntesis; | |
por hidrólisis de ATP. |
Los sistemas de transporte activo son los más abundantes entre las
bacterias, y se han seleccionado evolutivamente debido a que en sus medios
naturales la mayoría de los procariotas se encuentran de forma permanente o
transitoria con una baja concentración de nutrientes.
Los sistemas de transporte activo están basados en permeasas específicas
e inducibles. El modo en que se
acopla la energía metabólica con el transporte del soluto aún no está
dilucidado, pero en general se maneja la hipótesis de que las permeasas, una
vez captado el sustrato con gran afinidad, experimentan un cambio conformacional
dependiente de energía que les hace perder dicha afinidad, lo que supone la
liberación de la sustancia al interior celular.
Estudiaremos los siguientes tipos de
transporte activo:
transporte activo:
transporte activo ligado a simporte de protones; | |
transporte activo ligado a simporte de iones Na+ | |
transporte activo dirigido por ATP | |
transporte acoplado a translocación de grupos. |
2.3.1
TRANSPORTE ACTIVO LIGADO A SIMPORTE DE PROTONES
Como se recordará, el simporte se puede definir como el transporte
simultáneo de dos sustratos en la misma dirección, por un mismo transportador
sencillo. En el caso del transporte activo ligado a simporte de protones, lo que
ocurre es que uno de los sustratos (H+) ha creado previamente un
gradiente de concentración, cuya disipación es aprovechada por el otro
sustrato para entrar con él. Este otro sustrato puede ser:
una molécula de carga negativa: en este caso, su simporte ligado a protones tiende a disipar sólo el gradiente de concentración. Ejemplos: transporte de iones fosfato, de glutamato, etc. | |
una molécula neutra: en este caso, su simporte tiende a disipar no sólo el gradiente de concentración, sino también el gradiente eléctrico. Ejemplo: en Escherichia coli, la lactosa usa una ß-galactósido-permeasa, que es una de las permeasas bacterianas más intensamente estudiadas. |
Por
otro lado, ciertas moléculas catiónicas (iones K+, lisina), son
transportadas directamente a través de permeasas, en ausencia de simporte de
protones.
otro lado, ciertas moléculas catiónicas (iones K+, lisina), son
transportadas directamente a través de permeasas, en ausencia de simporte de
protones.
2.3.2
TRANSPORTE ACTIVO LIGADO A SIMPORTE DE IONES SODIO
Se puede considerar una versión modificada del anterior: algunas
sustancias no son transportadas activamente de forma directa por el potencial
electroquímico de protones, sino indirectamente, a través de un gradiente de
Na+ que a su vez se origina a expensas de dicha fuerza protón-motriz
(fpm).
El sustrato entra por una permeasa, junto con iones Na+, pero
a su vez este sodio se recicla por un sistema de antiporte, a expensas de la
disipación del potencial de protones.
Ejemplo: el azúcar melibiosa, en el caso de la enterobacteria E. coli.
Estos dos tipos de transporte activo
ligados a simporte quedan inhibidos si tratamos las células con algún agente ionóforo
(p. ej., el antibiótico valinomicina), que destruye el potencial electroquímico
de protones.
ligados a simporte quedan inhibidos si tratamos las células con algún agente ionóforo
(p. ej., el antibiótico valinomicina), que destruye el potencial electroquímico
de protones.
El transporte activo ligado a simporte de iones (H+, Na+)
resulta muy económico, ya que sólo se gasta un protón por cada molécula
transportada, mientras que por cada ATP sintetizado se suelen gastar 3 protones
que se disipan en las ATPasas. Las permeasas que realizan este transporte suelen
ser proteínas integrales de membrana provistas de unos 12 segmentos
transmembranosos en configuración de a-hélice.
2.3.3
TRANSPORTE ACTIVO DIRIGIDO POR ATP
El tipo paradigmático de este tipo de transporte se denomina de transportadores
ABC o ATPasas de tráfico, y
se conocen muchos ejemplos en eubacterias y arqueas. Vamos a describir el
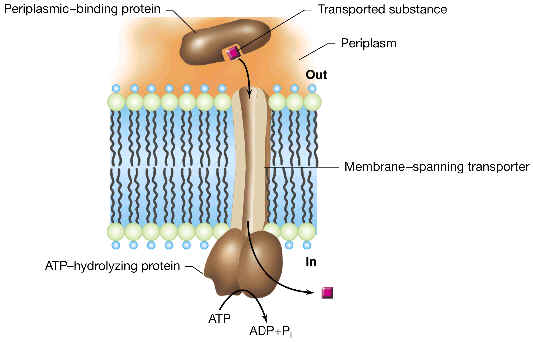
caso de un sistema ABC en enterobacterias (como E. coli). Se trata de un
sistema de varios componentes, en el que existen proteínas periplásmicas que
captan el sustrato con gran afinidad, y lo llevan hasta unas proteínas de
membrana, las cuales acoplan el paso de dicho sustrato hasta el citoplasma (sin
alteralo químicamente) con la hidrólisis de ATP.
La denominación
de "transportadores ABC" se debe a que en todos ellos existe una o
dos proteínas periféricas de membrana citoplásmica que poseen un dominio
(de unos 200 aminoácidos) conservado evolutivamente, denominado
"cassette de unión a ATP" (las iniciales de ATP-binding
cassette generan la sigla "ABC"). Al parecer este dominio ABC
conservado es muy antiguo, y parece que ya existía antes de la divergencia
evolutiva entre procariotas y eucariotas. Existen muchos ejemplos de proteínas
ABC, tanto en procariotas como eucariotas (de hecho constituyen la mayor
familia de proteínas filogenéticamente relacionadas de todo el mundo vivo).
Los primeros ejemplos de esta gran familia estaban implicados en transportar
sustancias a uno u otro lado de la membrana. En otro tema veremos ejemplos de
transportadores ABC que funcionan "al revés" de los de este tema:
son "exportadores" de proteínas recién sintetizadas que deben
insertarse en las envueltas bacterianas o ser excretadas al medio. Pero se ha
descubierto que la gran familia de proteínas ABC está implicada en otros
procesos (regulación genética, reparación de ADN, patogenicidad, etc).
Elementos
de este tipo de sistema:
de este tipo de sistema:
Porinas u otras proteínas de membrana externa para lograr la difusión del sustrato desde el medio hasta el espacio periplásmico. | |
Proteína(s) solubles de espacio periplásmico que se unen al sustrato con gran afinidad. | |
Un heterodímero formado por dos proteínas integrales de membrana (cada una de ellas posee 5 o 6 trechos en a-hélice que atraviesan la membrana citoplásmica), que son la permeasa propiamente dicha del sistema (el canal por donde pasa el sustrato). | |
Dos proteínas periféricas de membrana citoplásmica, adosadas al lado citoplásmico, que incluyen el módulo conservado ABC que acopla la hidrólisis de ATP con el transporte unidireccional del sustrato a través de la membrana. |
Modelo
del mecanismo de este sistema:
del mecanismo de este sistema:
1.
El sustrato exógeno normalmente entra al periplasma a través de algún
canal inespecífico o porina de membrana externa (por ejemplo, en
enterobacterias se pueden usar las porinas generales conocidas como OmpF y
OmpC).
El sustrato exógeno normalmente entra al periplasma a través de algún
canal inespecífico o porina de membrana externa (por ejemplo, en
enterobacterias se pueden usar las porinas generales conocidas como OmpF y
OmpC).
2.
La proteína periplásmica específica, antes de su unión al sustrato
tiene una determinada configuración (denominada “abierta”), con dos grandes
lóbulos globulares unidos formando un ángulo (la forma recuerda una almeja a
medio abrir). Cuando el sustrato pasa al periplasma, la correspondiente proteína
de unión periplásmica se une a él con gran afinidad (0.1-1 mM),
y al unirse cambia de conformación. En esta configuración, llamada
“cerrada”, el sustrato se encuentra “enterrado” entre los dos lóbulos
de la proteína (“almeja cerrada”).
La proteína periplásmica específica, antes de su unión al sustrato
tiene una determinada configuración (denominada “abierta”), con dos grandes
lóbulos globulares unidos formando un ángulo (la forma recuerda una almeja a
medio abrir). Cuando el sustrato pasa al periplasma, la correspondiente proteína
de unión periplásmica se une a él con gran afinidad (0.1-1 mM),
y al unirse cambia de conformación. En esta configuración, llamada
“cerrada”, el sustrato se encuentra “enterrado” entre los dos lóbulos
de la proteína (“almeja cerrada”).
3.
Mientras tanto, el dímero de proteínas integrales de membrana (antes de
la unión con la proteína periplásmica) se encuentra en un estado energizado
pero incapaz de transportar sustrato. En esta situación, puede unirse (por la
parte que da al periplasma) al complejo formado por la proteína periplásmica
(en configuración “cerrada”) ligada al sustrato. Al hacer esto, el heterodímero
de membrana cambia de conformación, de modo que ahora muestra mayor afinidad
hacia la proteína periplásmica y se abre su canal para dejar entrar el
sustrato.
Mientras tanto, el dímero de proteínas integrales de membrana (antes de
la unión con la proteína periplásmica) se encuentra en un estado energizado
pero incapaz de transportar sustrato. En esta situación, puede unirse (por la
parte que da al periplasma) al complejo formado por la proteína periplásmica
(en configuración “cerrada”) ligada al sustrato. Al hacer esto, el heterodímero
de membrana cambia de conformación, de modo que ahora muestra mayor afinidad
hacia la proteína periplásmica y se abre su canal para dejar entrar el
sustrato.
4.
Entonces, el complejo de membrana alcanza su estado de mínima energía,
y con ello descarga el sustrato en el citoplasma y se logra la separación de la
proteína periplásmica (que vuelve a su configuración “abierta”).
Entonces, el complejo de membrana alcanza su estado de mínima energía,
y con ello descarga el sustrato en el citoplasma y se logra la separación de la
proteína periplásmica (que vuelve a su configuración “abierta”).
5.
Finalmente, la hidrólisis de ATP catalizada por las proteínas periféricas
ABC (adosadas a la membrana y asociadas a las proteínas integrales) suministra
la energía para que el heterodímero de membrana vuelva a su estado energizado
inicial, preparado así para otro ciclo de transporte.
Finalmente, la hidrólisis de ATP catalizada por las proteínas periféricas
ABC (adosadas a la membrana y asociadas a las proteínas integrales) suministra
la energía para que el heterodímero de membrana vuelva a su estado energizado
inicial, preparado así para otro ciclo de transporte.
El
sistema ABC de bacterias Gram-negativas, queda puesto de manifiesto cuando lo
impedimos por algún procedimiento que altere o elimine la membrana externa
(conversión a esferoplastos): Por ejemplo: tratemos E.
coli con el quelante EDTA en una solución tamponada isotónica (con un 20%
de sacarosa). Centrifugamos y el sedimento de células lo resuspendemos en una
solución de MgCl2 en frío (0ºC). El resultado es que las proteínas
del periplasma escapan al medio externo. Esto es un caso de tratamiento por choque
osmótico que origina pérdida de contenidos del periplasma. Se comprueba
que ciertos sistemas de transporte quedan inutilizados, debido a que requieren
para su funcionamiento, amén de proteínas
de membrana citoplásmica, otras específicas del espacio periplásmico. Por
contra, este sistema no se ve afectado por los agentes ionóforos. Por esta razón,
a este sistema en Gram-negativas se le ha llamado durante mucho tiempo “transporte
activo sensible a choque osmótico”.
sistema ABC de bacterias Gram-negativas, queda puesto de manifiesto cuando lo
impedimos por algún procedimiento que altere o elimine la membrana externa
(conversión a esferoplastos): Por ejemplo: tratemos E.
coli con el quelante EDTA en una solución tamponada isotónica (con un 20%
de sacarosa). Centrifugamos y el sedimento de células lo resuspendemos en una
solución de MgCl2 en frío (0ºC). El resultado es que las proteínas
del periplasma escapan al medio externo. Esto es un caso de tratamiento por choque
osmótico que origina pérdida de contenidos del periplasma. Se comprueba
que ciertos sistemas de transporte quedan inutilizados, debido a que requieren
para su funcionamiento, amén de proteínas
de membrana citoplásmica, otras específicas del espacio periplásmico. Por
contra, este sistema no se ve afectado por los agentes ionóforos. Por esta razón,
a este sistema en Gram-negativas se le ha llamado durante mucho tiempo “transporte
activo sensible a choque osmótico”.
Los sistemas ABC de bacterias
Gram-positivas están menos estudiados, pero en general se parecen a los de
Gram-negativas, salvo que carecen del transportador libre periplásmico. En su
lugar existe una proteína con funciones equivalentes (captar el nutriente del
exterior), pero que está anclada al lado externo de la membrana citoplásmica,
cerca del heterodímero integral de membrana (la unión es mediante su cisteína
N-terminal, que se une a un fosfolípido).
Gram-positivas están menos estudiados, pero en general se parecen a los de
Gram-negativas, salvo que carecen del transportador libre periplásmico. En su
lugar existe una proteína con funciones equivalentes (captar el nutriente del
exterior), pero que está anclada al lado externo de la membrana citoplásmica,
cerca del heterodímero integral de membrana (la unión es mediante su cisteína
N-terminal, que se une a un fosfolípido).
Existen muchos ejemplos de transportadores procarióticos de tipo ABC, y
cada uno de ellos está especializado en transportar un sustrato específico o
varios sustratos parecidos. Ejemplo de sustratos transportados de esta forma:
Monosacáridos como arabinosa, galactosa, maltosa, ribosa, xilosa, etc. | |
Oligosacáridos | |
Iones orgánicos e inorgánicos | |
Aminoácidos como histidina, glicina, leucina, etc. | |
Oligopéptidos | |
Algunas vitaminas y metales. | |
Sideróforos con hierro |
2.3.4
TRANSPORTE ACOPLADO A TRANSLOCACION DE GRUPOS
Es un sistema de transporte que acopla la entrada del sustrato con su
modificación química por unión covalente con un grupo químico. Estrictamente
hablando, no es un transporte activo, porque no funciona en contra de un
gradiente de concentración, pero se considera de hecho como activo, ya que la
concentración del sustrato modificado
dentro de la célula supera con creces a la del sustrato sin
modificar en el exterior.
Este sistema supone un ahorro de energía metabólica: aunque en el
transporte se gasta un enlace rico en energía, el sustrato queda modificado en
su paso a través de la membrana en la forma que la bacteria emplea como primer
intermediario de su ruta metabólica. Es decir, con un solo proceso se cumplen
dos funciones distintas: transporte y preparación química para la ruta, que de
todas formas habría que realizar. No es de extrañar que este tipo de
transporte haya sido seleccionado frecuentemente en la evolución bacteriana, y
que hoy lo encontremos en muchos procariotas, especialmente en bacterias
anaerobias o aerobias facultativas que recurren a fermentaciones (recordar que
las fermentaciones tienen un rendimiento energético menor que los procesos
respiratorios; por lo tanto, es “lógico” que se seleccionen mecanismos
ahorradores como el descrito).
El caso mejor estudiado de esta clase de transporte lo constituye el
llamado sistema de
fosfotransferasa de azúcares (según las casi inevitables
iniciales inglesas: PTS).
En E. coli el sistema PTS
permite el transporte de glucosa, manosa, fructosa y los polioles sorbitol y
manitol.
Consta de varios componentes que funcionan como una cadena de
transportadores del grupo fosfato de alta energía del fosfoenolpirúvico (PEP)
hasta el azúcar a transportar en cuestión.
Las dos primeras proteínas son inespecíficas respecto del azúcar (son comunes a los diversos sustratos a transportar), tienen localización citoplásmica y su síntesis es constitutiva. Se conocen como
| |||||||
El otro componente, llamado Enzima II (EII) es específico de cada azúcar, y su síntesis es inducible por el correspondiente sustrato: Suele estar compuesto por tres subunidades o dominios:
|
Veamos cómo funciona el
sistema:
sistema:
1.
Por un lado, el azúcar se une al enzima EIIC específico, pero éste por
sí mismo no puede liberar al azúcar sin modificar en el interior celular.
Por un lado, el azúcar se une al enzima EIIC específico, pero éste por
sí mismo no puede liberar al azúcar sin modificar en el interior celular.
2.
Mientras tanto, la EI cataliza (en presencia de Mg++) la
transferencia del fosfato de alta energía del PEP a la HPr.
Mientras tanto, la EI cataliza (en presencia de Mg++) la
transferencia del fosfato de alta energía del PEP a la HPr.
3.
La HPr fosforilada (HPr-P) transfiere el fosfato al enzima IIA específico
del azúcar [p. ej., la glucosa (EIIAGlc ) o el manitol (EIIAMtl)].
La HPr fosforilada (HPr-P) transfiere el fosfato al enzima IIA específico
del azúcar [p. ej., la glucosa (EIIAGlc ) o el manitol (EIIAMtl)].
4.
La EIIA-P rápidamente, y en presencia de Mg++, transfiere el
fosfato a la enzima-IIB específica con la que se asocia (p. ej., EIIBGlc),
que a su vez fosforila el azúcar (en el caso de la glucosa convirtiéndola en
glucosa-6-P): en este momento la EIIC pierde su afinidad por el azúcar
modificado, que de esta forma entra en el citoplasma, preparado ya para actuar
como sustrato de la primera reacción del catabolismo de este azúcar.
La EIIA-P rápidamente, y en presencia de Mg++, transfiere el
fosfato a la enzima-IIB específica con la que se asocia (p. ej., EIIBGlc),
que a su vez fosforila el azúcar (en el caso de la glucosa convirtiéndola en
glucosa-6-P): en este momento la EIIC pierde su afinidad por el azúcar
modificado, que de esta forma entra en el citoplasma, preparado ya para actuar
como sustrato de la primera reacción del catabolismo de este azúcar.
Otros ejemplos de transporte acoplado
a translocación de grupos:
a translocación de grupos:
Entrada de ácidos grasos mediante un sistema de transferencia de Coenzima A, que los transforma en acil-CoA. | |
Entrada de purinas y pirimidinas, mediante un sistema de fosforribosil-transferasas: |
purina o pirimidina (exterior) + PRPP à
NMP (interior) + P
NMP (interior) + P
(PRPP = fosforribosil-pirofosfato)
(NMP = nucleósido monofosfato)
En bacterias es frecuente encontrar varios sistemas de transporte para un
mismo nutriente (p. ej., Escherichia coli
posee cinco sistemas para transportar la galactosa y tres sistemas para algunos
de los aminoácidos. Los diversos sistemas se diferencian en cuanto a su
requerimiento energético, su afinidad, su regulación, etc. Lógicamente, la
evolución ha debido seleccionar esta redundancia de sistemas de transporte con
objeto de permitir que el microorganismo sobreviva bajo diversas circunstancias
ambientales.
2.4
TRANSPORTE DE HIERRO
El hierro es un cofactor de muchas enzimas y citocromos, por lo que las
bacterias necesitan captarlo. La captación de hierro se complica porque el ión
férrico (Fe3+) es muy insoluble. Además, las bacterias que viven
dentro de animales superiores tienen un problema: en los fluidos y tejidos de
sus patrones el hierro libre es muy poco abundante (el hierro suele estar
acomplejado con proteínas), por lo que se vuelve vital aprovisionarse con este
elemento de alguna manera.
Muchas bacterias secretan unas moléculas de bajo peso molecular llamadas
en general sideróforos,
que son capaces de formar quelatos (complejos) con el hierro férrico. Por
ejemplo, Escherichia coli secreta un sideróforo llamado enterobactina.
Cuando la enterobactina se une al hierro, forma un complejo octaédrico, que
luego se engarza con un receptor específico de la membrana externa, tras lo que
el hierro se libera al espacio periplásmico, desde donde entra al citoplasma
por medio de una proteína de unión periplásmica acoplada a un sistema ABC
similar al visto más arriba.
3
ESTRUCTURAS MEMBRANOSAS INTRACITOPLÁSMICAS
3.1
MESOSOMAS
Son estructuras membranosas intracitoplásmicas que se observan en la
mayor parte de las bacterias, constituidas por invaginaciones de la membrana
citoplásmica.
Observación:
A microscopio óptico se pueden detectar con tinción negativa con ácido
fosfotúngstico. A microscopio electrónico se observa que, por lo general, el
mesosoma se ubica en determinadas localizaciones: sitios donde se inicia la
división celular; tabiques transversales en crecimiento (incluyendo los que
delimitan el compartimento de la endospora); zonas cercanas a los nucleoides
(cuerpos nucleares). Desde hace mucho tiempo se viene discutiendo si los
mesosomas son en realidad estructuras auténticas de la bacteria, o como dicen
otros, meros artefactos de las técnicas microscópicas empleadas. El debate aún
no está apagado, según algunos destacados microbiólogos.
Estructura
y composición:
y composición:
Los mesosomas más característicos y patentes son los de bacterias
Gram-positivas. Su aspecto al microscopio electrónico es el de repetidas
invaginaciones de la membrana: una invaginación primaria en forma de sáculo
irregular, de la que surge una invaginación secundaria, llamada túbulo mesosómico,
que rellena el hueco de la invaginación primaria. El túbulo mesosómico suele
consistir en un conjunto de pequeñas vesículas arrosariadas, o túbulos,
conectados entre sí, a veces con aspecto de cebolla.
Los mesosomas de Gram-negativas son menos conspicuos y menos complejos:
se manifiestan como pequeñas invaginaciones de la membrana, con forma laminar o
a base de tubos dispuestos de forma verticilada.
Funciones:
La porción de membrana del mesosoma correspondiente a la invaginación primaria (pero no así a la secundaria) posee una composición semejante a la de la membrana citoplásmica, por lo que se le pueden aplicar los papeles que ya hemos estudiado (transporte de electrones, síntesis de componentes de las envueltas...). | |
Probable papel en la síntesis del septo transversal, quizá regulando las autolisinas implicadas en la división celular (véase tema 5bis). | |
Puntos de anclaje del cromosoma bacteriano (y quizá de algunos plásmidos), actuando en la segregación de los cromosomas hijos a las células hermanas (y en el caso de las bacterias esporuladas, en la segregación de los cromosomas a los compartimentos de la célula madre (esporangio) y de la preespora. | |
Zonas de secreción de ciertas exoenzimas (p. ej., penicilinasa en Bacillus). |
3.2
CROMATÓFOROS
Son invaginaciones de la membrana citoplásmica de las bacterias purpúreas
(un grupo de bacterias fotosintéticas anoxigénicas) que albergan su aparato
fotosintético. Dependiendo de las especies, pueden adoptar formas variadas:
A modo de vesículas huecas; | |
capas de repliegues concéntricos, a modo de láminas paralelas, cercanas a la membrana citoplásmica; | |
formando túbulos, aislados o en haces. |
Los cromatóforos suponen obviamente una adaptación para aumentar la
superficie de membrana útil capaz de realizar las funciones propias de la fotosíntesis.
3.3
OTRAS INVAGINACIONES
En muchas bacterias quimiolitoautrofas (especialmente las nitrificantes)
existen invaginaciones de la membrana (a menudo denominadas citomembranas) que
permiten una mayor superficie para la realización de sus actividades
respiratorias. Sus formas y disposiciones son igualmente muy variadas (véanse fotomicrografías).
En Azotobacter, una bacteria
aerobia fijadora de nitrógeno atmosférico, y que presenta una altísima tasa
respiratoria, se pueden detectar también invaginaciones de membrana que
aumentan la superficie disponible para sus intensos procesos de oxidación.
3.4
TILACOIDES
Son sacos membranosos aplastados presentes en las cianobacterias, que no
están en continuidad con la membrana citoplásmica; en su cara externa se
disponen filas de ficobilisomas (véase
capítulo 7). El conjunto de membrana tilacoidal + ficobilisomas es el
responsable de la fotosíntesis oxigénica en este grupo de procariotas.
BIBLIOGRAFÍA
BOOS, W., J.M. LUCHT. (1996):
Periplasmic binding protein-dependent ABC transporters. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C., págs. 1175-1223.
Periplasmic binding protein-dependent ABC transporters. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C., págs. 1175-1223.
DANCHIN,
A. (1987): Membrane integration of carbohydrate transport in bacteria.
Microbiol. Sci. 4: 267-269.
A. (1987): Membrane integration of carbohydrate transport in bacteria.
Microbiol. Sci. 4: 267-269.
DREWS,
G. (1992): Intracytoplasmic membranes in bacterial cells: organization, function
and biosynthesis. En “Prokaryotic structure and function: a new
perspective”. Society for General Microbiology & Cambridge University
Press, Cambridge, pp. 249-274.
G. (1992): Intracytoplasmic membranes in bacterial cells: organization, function
and biosynthesis. En “Prokaryotic structure and function: a new
perspective”. Society for General Microbiology & Cambridge University
Press, Cambridge, pp. 249-274.
GLAZER,
A.N. (1982): Phycobilisomes: structure and dinamics. Ann. Rev. Microbiol. 36:
173-198.
A.N. (1982): Phycobilisomes: structure and dinamics. Ann. Rev. Microbiol. 36:
173-198.
GOLDFINE,
H., T.A. LANGWORTHY (1988): A growing interest in bacterial ether lipids. Trends
Biochem. Sci. 13: 217-221.
H., T.A. LANGWORTHY (1988): A growing interest in bacterial ether lipids. Trends
Biochem. Sci. 13: 217-221.
KABACK,
H.R., E. BIBI, P.D. ROEPE (1990): Beta-galactoside transport in Escherichia
coli: a functional dissection of lac
permease. Trends Biochem. Sci. 15:
309-314.
H.R., E. BIBI, P.D. ROEPE (1990): Beta-galactoside transport in Escherichia
coli: a functional dissection of lac
permease. Trends Biochem. Sci. 15:
309-314.
KADNER,
R.J. (1996): Cytoplasmic membrane. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C., págs.
58-86.
R.J. (1996): Cytoplasmic membrane. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C., págs.
58-86.
MALONEY,
P.C., T. HASTINGS WILSON (1996): Ion-coupled transport and transporters. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C., págs. 1130-1147.
P.C., T. HASTINGS WILSON (1996): Ion-coupled transport and transporters. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C., págs. 1130-1147.
POSTMA,
P.W., J.W. LENGELER, G.R. JACOBSON (1996): Phosphoenol-pyruvate: carbohydrate
phosphotransferase systems. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C. (1996), págs.
1149-1173.
P.W., J.W. LENGELER, G.R. JACOBSON (1996): Phosphoenol-pyruvate: carbohydrate
phosphotransferase systems. En: “Escherichia
coli and Salmonella typhimurium.
Cellular and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American
Society for Microbiology Press. Washington, D.C. (1996), págs.
1149-1173.
WHITE,
D. (1995): “The physiology and biochemistry of Prokaryotes”. Oxford
University Press, Nueva York y Oxford. Consultar el
capítulo 15 (transporte de solutos).
D. (1995): “The physiology and biochemistry of Prokaryotes”. Oxford
University Press, Nueva York y Oxford. Consultar el
capítulo 15 (transporte de solutos).
ENLACES
| Repaso a composición química y estructura de las membranas (con abundantes ilustraciones) | |
Unas sencillas animaciones sobre los mecanismos de transporte (nececitas tener instalado el programa gratuito Shockwave) | |
Más animaciones sobre transporte, de Wiley | |
| En esta página encontrarás información útil sobre sistemas de transporte, y varios modelos 3-D que podrás mover a placer con tu ratón (necesitas tener instalado un programa tipo Chime, RasMol, etc.)I |
Secciones de esta web:
Actualizado el
miércoles, 15 de febrero de 2006
miércoles, 15 de febrero de 2006




No hay comentarios:
Publicar un comentario