1
INTRODUCCIÓN
En el capítulo anterior estudiamos la composición química, estructura
y funciones de los principales tipos de paredes celulares procarióticas. En
este capítulo trataremos un aspecto dinámico del tema de las paredes: cómo se
sintetiza el peptidoglucano de las eubacterias, y cómo se produce el proceso
general de crecimiento de la pared, incluyendo el evento particular de formación
del septo transversal que marca el “nacimiento” de dos células hijas. Nos
concentraremos en la biosíntesis del peptidoglucano, debido a su interés intrínseco
y aplicado (sobre este proceso actúan diversos antibióticos, algunos de gran
importancia clínica).
Desde el punto de vista topológico, todas las capas de las envueltas bacterianas (membranas, pared celular) son superficies cerradas sobre sí mismas, físicamente continuas para mantener la integridad y viabilidad de la célula. | |
Pero por otro lado, deben de ser susceptibles de expandirse durante el crecimiento por incorporación de nuevos materiales. Además, todos los constituyentes deben crecer coordinadamente e incorporarse en los lugares precisos. Por ejemplo, en el caso de las bacterias Gram-negativas, distintos componentes deben de ir a parar a diferentes localizaciones: periplasma, PG, membrana externa, e incluso medio exterior. | |
Durante cada ciclo celular, hay una fase en la que los materiales de las envueltas (y concretamente, de la pared celular que nos ocupa ahora) deben de facilitar la división de la célula en una descendencia de dos células hijas. | |
Finalmente, queda el problema de la energía. Los procesos biosintéticos requieren aporte de energía química, pero el ATP y compuestos similares no pueden salir del protoplasto. |
Precisamente en este capítulo vamos a
ver algunas de las estrategias bioquímicas y moleculares que las bacterias han
evolucionado para solventar estos puntos para el caso del peptidoglucano.
Veremos que la estrategia implica varias fases:
ver algunas de las estrategias bioquímicas y moleculares que las bacterias han
evolucionado para solventar estos puntos para el caso del peptidoglucano.
Veremos que la estrategia implica varias fases:
Síntesis de precursores en el citoplasma | |
Ensamblaje parcial en membrana | |
Transporte a la cara externa externa de la membrana | |
Ensamblaje final en el exterior, mediante reacciones que no precisan energía |
2
BIOSÍNTESIS DEL PEPTIDOGLUCANO DE MUREÍNA
Consta de 4 etapas:
1.
Síntesis de precursores solubles en el citoplasma.
Síntesis de precursores solubles en el citoplasma.
2.
Estos precursores son transferidos a un transportador lipídico situado
en la membrana citoplásmica (un poliisoprenol fosfatado llamado
undecaprenil-fosfato), donde se forman las unidades disacarídicas con el pentapéptido.
Estos precursores son transferidos a un transportador lipídico situado
en la membrana citoplásmica (un poliisoprenol fosfatado llamado
undecaprenil-fosfato), donde se forman las unidades disacarídicas con el pentapéptido.
3.
Las unidades disacarídicas se polimerizan en cadenas lineales fuera de
la membrana, pero aún unidas al undecaprenil-fosfato de la membrana.
Las unidades disacarídicas se polimerizan en cadenas lineales fuera de
la membrana, pero aún unidas al undecaprenil-fosfato de la membrana.
4.
Unión del polímero lineal así formado al peptidoglucano preexistente
en la pared celular, por entrecruzamiento de (al menos) parte de sus péptidos
respectivos.
Unión del polímero lineal así formado al peptidoglucano preexistente
en la pared celular, por entrecruzamiento de (al menos) parte de sus péptidos
respectivos.
A estas etapas hay que añadir una
fase adicional de regeneración del transportador lipídico, una vez que ha
cumplido su misión, para que pueda ser operativo en un nuevo ciclo de síntesis.
fase adicional de regeneración del transportador lipídico, una vez que ha
cumplido su misión, para que pueda ser operativo en un nuevo ciclo de síntesis.
Veamos, pues, en más detalle, cómo
ocurre este interesante proceso:
ocurre este interesante proceso:
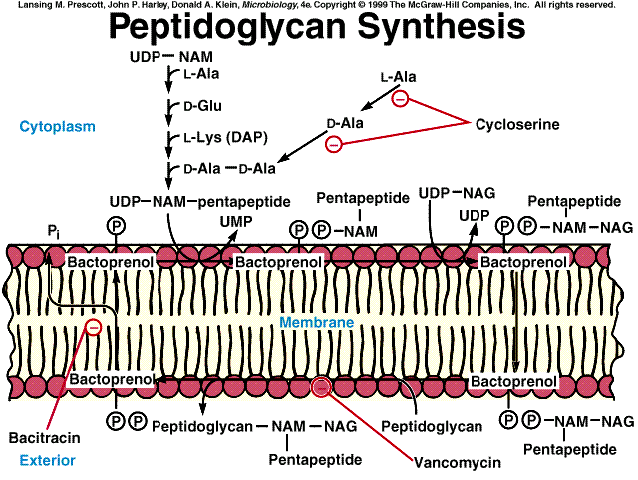
Fase
1:. Los monosacáridos que luego van a
constituir la unidad disacarídica repetitiva del esqueleto del peptidoglucano (NAM
y NAG) se activan al unirse a uridín difosfato (UDP). (En general,
los monosacáridos que han de incorporarse a polímeros de pared celular
bacteriana se activan mediante su unión con nucleósidos-fosfato.)
1:. Los monosacáridos que luego van a
constituir la unidad disacarídica repetitiva del esqueleto del peptidoglucano (NAM
y NAG) se activan al unirse a uridín difosfato (UDP). (En general,
los monosacáridos que han de incorporarse a polímeros de pared celular
bacteriana se activan mediante su unión con nucleósidos-fosfato.)
Por lo tanto, en esta fase se
sintetizan por separado:
sintetizan por separado:
NAG-UDP | |
NAM-UDP |
Luego se va produciendo la adición
secuencial y ordenada de los distintos aminoácidos al NAM (en
reacciones que requieren energía e iones Mn++):
secuencial y ordenada de los distintos aminoácidos al NAM (en
reacciones que requieren energía e iones Mn++):
1.
L-ala
L-ala
2.
D-glu
D-glu
3.
m-DAP (u otro diaminoácido; p. ej. L-lys
en Staphylococcus aureus)
m-DAP (u otro diaminoácido; p. ej. L-lys
en Staphylococcus aureus)
4.
D-ala-D-ala
D-ala-D-ala
Observar que no se produce un tetrapéptido, sino un pentapétido.
El último paso de adición de aminoácidos es la unión del dipéptido
D-alanil-D-alanina, que se ha sintetizado en dos fases:
una racemasa convierte la L-ala a D-ala; | |
creación de enlace peptídico entre dos D-ala. |
Fase
2: El UDP-NAM-pentapéptido se transfiere ahora
a un transportador de membrana, llamado undecaprenil-fosfato
(que abreviaremos como Lip-P), en una reacción catalizada por una translocasa
específica.
2: El UDP-NAM-pentapéptido se transfiere ahora
a un transportador de membrana, llamado undecaprenil-fosfato
(que abreviaremos como Lip-P), en una reacción catalizada por una translocasa
específica.
El undecaprenil-fosfato es un poliisoprenoide de 55 átomos de C (C55,
derivado de la repetición 11 veces de la unidad isoprenoide, con un fosfato
terminal). Se le conoce también con el nombre de bactoprenol, pero hoy se sabe que no es
exclusivo de bacterias. El bactoprenol permite el transporte y ensamblaje de
sustancias que, como los azúcares, son hidrofílicas, y no podrían pasar por sí
mismas la barrera hidrofóbica de la membrana.
Una vez que el NAM-pentapétido está unido al undecaprenil (por medio de
pirofosfato), una transferasa transfiere a
éste la NAG desde el UDP-NAG. Se genera pues el enlace ß(1à4)
entre NAG y NAM. Por lo tanto, se obtiene: Lip-P-P-NAM(pentapéptido)-NAG.
En esta
situación es cuando se producen la modificaciones que ya estudiamos en la
estructura básica del PG. Por ejemplo: en Staphylococcus
aureus el grupo -COOH del D-glutámico en posición (2) es amidado (pasa a
--CO-NH2. Por otro lado, se introducen los puentes peptídicos,
que en el caso de esta bacteria consisten en una pentaglicina, que se une al
grupo amino terminal de la L-Lys en posición (3).
situación es cuando se producen la modificaciones que ya estudiamos en la
estructura básica del PG. Por ejemplo: en Staphylococcus
aureus el grupo -COOH del D-glutámico en posición (2) es amidado (pasa a
--CO-NH2. Por otro lado, se introducen los puentes peptídicos,
que en el caso de esta bacteria consisten en una pentaglicina, que se une al
grupo amino terminal de la L-Lys en posición (3).
Tanto
la traslocasa como la transferasa está localizadas en el lado citoplásmico de
la membrana, de modo que el precursor Lip-P-P-NAM(pentapéptido)-NAG, en este
momento está “colgando” hacia el citoplasma, anclado a la lámina interna
de la membrana a través de bactoprenol.
la traslocasa como la transferasa está localizadas en el lado citoplásmico de
la membrana, de modo que el precursor Lip-P-P-NAM(pentapéptido)-NAG, en este
momento está “colgando” hacia el citoplasma, anclado a la lámina interna
de la membrana a través de bactoprenol.
Fase 3: Polimerización
de varias unidades disacarídicas: Ahora el bactoprenol “se
da la vuelta” en la membrana (una especie de flip-flop desde la capa interna
hasta la externa), de modo que logra que el precursor resultante de la fase 2
quede expuesto hacia el medio acuoso exterior a la membrana. Entonces tiene
lugar la polimerización de varias unidades disacarídicas: ello se logra en una
reacción de transglucosidación.
Consiste en la unión de cada unidad disacarídica (con su pentapéptido) unida
a su respectivo Lip-P-P, con el extremo libre (reductor) de una cadena
preexistente que a su vez está unida a otra molécula de Lip-P-P.
de varias unidades disacarídicas: Ahora el bactoprenol “se
da la vuelta” en la membrana (una especie de flip-flop desde la capa interna
hasta la externa), de modo que logra que el precursor resultante de la fase 2
quede expuesto hacia el medio acuoso exterior a la membrana. Entonces tiene
lugar la polimerización de varias unidades disacarídicas: ello se logra en una
reacción de transglucosidación.
Consiste en la unión de cada unidad disacarídica (con su pentapéptido) unida
a su respectivo Lip-P-P, con el extremo libre (reductor) de una cadena
preexistente que a su vez está unida a otra molécula de Lip-P-P.
En el proceso se libera uno de los Lip-P-P (o sea, el undecaprenil, pero
en forma pirofosforilada). Sobre este Lip-P-P actúa una fosfatasa específica,
que elimina el fosfato terminal, regenerándose el undecaprenil-fosfato, que
queda dispuesto para otro ciclo como el descrito.
Fase
4: El polímero surgido de la fase anterior es
una cadena lineal de PG sin entrecruzar, y unido aún al transportador lipídico
de membrana. Ahora este polímero naciente (con sus pentapéptidos) reacciona,
por transpeptidación,
con un PG aceptor preexistente. En esta reacción se ven implicados el grupo C=O
de la D-ala (4) del PG naciente y el grupo -NH2 libre del diaminoácido
(3) del PG aceptor (o del último aminoácido del puente peptídico).
4: El polímero surgido de la fase anterior es
una cadena lineal de PG sin entrecruzar, y unido aún al transportador lipídico
de membrana. Ahora este polímero naciente (con sus pentapéptidos) reacciona,
por transpeptidación,
con un PG aceptor preexistente. En esta reacción se ven implicados el grupo C=O
de la D-ala (4) del PG naciente y el grupo -NH2 libre del diaminoácido
(3) del PG aceptor (o del último aminoácido del puente peptídico).
Esto es
lo mismo que decir que el enlace peptídico entre D-ala (4) y D-ala (5) del PG
naciente se ve sustituido por otro enlace peptídico, entre dicha D-ala (4) y el
diaminoácido del PG naciente.
lo mismo que decir que el enlace peptídico entre D-ala (4) y D-ala (5) del PG
naciente se ve sustituido por otro enlace peptídico, entre dicha D-ala (4) y el
diaminoácido del PG naciente.
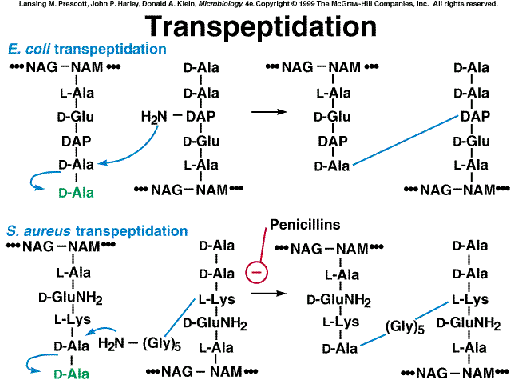
La energía para esta reacción la suministra la hidrólisis concomitante
del enlace peptídico entre las dos D-ala terminales. Es decir, en cada reacción
de transpeptidación se libera una D-ala, correspondiente a la que ocupaba la
posición (5).
Ya dijimos
en el capítulo anterior que no todos los tetrapéptidos participan en
entrecruzamientos. Las D-ala terminales (en 5) de los péptidos no implicados en
tales entrecruzamientos son eliminadas por una enzima llamada
D-D-carboxipeptidasa. Esta enzima explica no sólo que en el PG maduro existan
tetrapéptidos (y no los pentapéptidos originales), sino también la existencia
de tripéptidos.
en el capítulo anterior que no todos los tetrapéptidos participan en
entrecruzamientos. Las D-ala terminales (en 5) de los péptidos no implicados en
tales entrecruzamientos son eliminadas por una enzima llamada
D-D-carboxipeptidasa. Esta enzima explica no sólo que en el PG maduro existan
tetrapéptidos (y no los pentapéptidos originales), sino también la existencia
de tripéptidos.
Muchas bacterias controlan el grado de entrecruzamiento de su PG maduro.
Incluso algunas pueden eliminar totalmente muchos de los péptidos originalmente
unidos al NAM, mediante enzimas conocidas genéricamente con el nombre de autolisinas.
Así por ejemplo, Micrococcus luteus
-un coco Gram-positivo- merced a su actividad NAM-L-ala-amidasa, presenta un PG
que no está entrecruzado en un 50-70%.
Antibióticos
que actúan a nivel de la biosíntesis de peptidoglucano:
que actúan a nivel de la biosíntesis de peptidoglucano:
Estos antibióticos tienen un efecto bactericida
sobre bacterias en crecimiento. Ello se debe a que, al inhibir determinados
pasos del ciclo de síntesis y ensamblaje del PG, provocan
la acumulación de precursores de dicho PG, lo que a su vez
desencadena la activación
de las autolisinas de la bacteria, que degradan el PG y que
finalmente provoca la lisis celular (en medios hipotónicos), por entrada masiva
de agua a la célula.
1.
Fosfomicina:
actúa inhibiendo la formación del 3-O-D-lactil-éter de la NAG (o sea, del
NAM). Parece ser que la base molecular estriba en la semejanza estructural entre
el este antibiótico y el PEP (es decir, la fosfomicina es análogo estructural
del PEP, lo que lleva a la inactivación de la enzima correspondiente a esta
reacción).
Fosfomicina:
actúa inhibiendo la formación del 3-O-D-lactil-éter de la NAG (o sea, del
NAM). Parece ser que la base molecular estriba en la semejanza estructural entre
el este antibiótico y el PEP (es decir, la fosfomicina es análogo estructural
del PEP, lo que lleva a la inactivación de la enzima correspondiente a esta
reacción).
2.
Cicloserina:
Se comporta como análogo estructural de la D-alanina, por lo que inhibe la
actuación de la racemasa que convierte la L-ala a D-ala, así como de la reacción
de unión de dos D-ala.
Cicloserina:
Se comporta como análogo estructural de la D-alanina, por lo que inhibe la
actuación de la racemasa que convierte la L-ala a D-ala, así como de la reacción
de unión de dos D-ala.
3.
Tunicamicina: inhibe la traslocasa que cede el NAM unido hasta entonces al UDP y lo
pasa al bactoprenol (fase 2ª).
Tunicamicina: inhibe la traslocasa que cede el NAM unido hasta entonces al UDP y lo
pasa al bactoprenol (fase 2ª).
4.
Vancomicina
y ristocetina: inhiben la segunda
transglucosidación (fase 3ª), es decir, la unión de diversas unidades disacarídicas.
Vancomicina
y ristocetina: inhiben la segunda
transglucosidación (fase 3ª), es decir, la unión de diversas unidades disacarídicas.
5.
Bacitracina:
se une al undecaprenol-pirofosfato, bloqueando su desfosforilación, e
impidiendo por lo tanto, la regeneración del transportador de membrana.
Bacitracina:
se une al undecaprenol-pirofosfato, bloqueando su desfosforilación, e
impidiendo por lo tanto, la regeneración del transportador de membrana.
6.
Antibióticos
ß-lactámicos (p. ej.: penicilinas, cefalosporinas):
inhiben la reacción de entrecruzamiento por transpeptidación. (Estudiaremos
su mecanismo de acción en más detalle en el capítulo 20 sobre Quimioterápicos
y Antibióticos).
Antibióticos
ß-lactámicos (p. ej.: penicilinas, cefalosporinas):
inhiben la reacción de entrecruzamiento por transpeptidación. (Estudiaremos
su mecanismo de acción en más detalle en el capítulo 20 sobre Quimioterápicos
y Antibióticos).
3
CRECIMIENTO DE LA PARED CELULAR
Como ya dijimos al comienzo de este tema, aunque la pared celular es una
estructura cerrada y sin solución de continuidad, debe permitir su expansión
(crecimiento), y esto supone que se han de romper ciertos enlaces si se quiere
que el nuevo material se ensamble con el preexistente mediante nuevas uniones,
es decir, debe existir una acción concertada de mureín-hidrolasas y de mureín-sintasas.
Por otro lado, hay que tener en cuenta que en el crecimiento de la pared celular
se producen dos tipos de procesos: la expansión (aumento de tamaño) de esa
pared, y la formación del tabique transversal en el centro de la célula.
El crecimiento y septación del peptidoglucano están basados en la
actividad controlada y localizada en puntos determinados, de una gama de autolisinas,
especialmente las dotadas de actividad transglucosidasa y/o transpeptidasa.
Debido a que estas enzimas son los sitios de acción de las penicilinas (y otros
antibióticos ß-lactámicos), se les conoce también con el nombre de PBP (de penicillin-binding
proteins; véase la tabla 1).
TABLA
1
1
Propiedades de las PBPs de Escherichia coli
PBP |
Nº moléculas/ célula |
Actividad enzimática conocida |
Posibles funciones |
PBP 1ª, 1B |
100 cada una |
Transglucosilasa/transpeptidasa |
Síntesis de PG durante la elongación celular |
PBP 2 |
20 |
Transpeptidasa |
Crecimiento de la forma bacilar |
PBP 3 |
50 |
Transglucosidasa/transpeptidasa |
Síntesis de PG durante la septación (tabique) |
PBP 4 |
110 |
D-D-endopeptidasa/ D-Dcarboxipeptidasa |
Hidrólisis de los entrecruzamientos durante la elongación |
PBP 5 |
1800 |
D-D-carboxipeptidasa |
Destrucción del pentapéptido no entrecruzado |
3.1
CRECIMIENTO DE LA PARED EN UNA BACTERIA GRAM-NEGATIVA:
Escherichia coli
El crecimiento de la pared en E.
coli se puede considerar dividido en dos fases:
coli se puede considerar dividido en dos fases:
1.
Crecimiento en longitud (elongación), mientras la célula crece en tamaño.
Crecimiento en longitud (elongación), mientras la célula crece en tamaño.
2.
Producción del tabique transversal (septación), que conduce a la
formación de dos células hijas.
Producción del tabique transversal (septación), que conduce a la
formación de dos células hijas.
Elongación
Las PBPs 1 son las encargadas de la elongación de las cadenas de PG naciente (por transglucosidación de las unidades disacarídicas) y simultáneamente, por transpeptidación, logran el entrecruzamiento. | |
Las cadenas nacientes del PG se intercalan en la parte cilíndrica del sáculo de PG gracias a que las PBP4 y PBP5 cortan enlaces del PG preexistente. La PBP2 interviene aquí también para transpeptidación. La cadena de PG se va elongando unidireccionalmente alrededor de la circunferencia de la célula. Se calcula que existen unos 200 sitios de inserción de nuevo material en cada célula, dispersos de forma más o menos uniforme por toda la superficie de la célula. La maquinaria biosintética tarda 8 minutos en completar cada circunferencia de elongación. |
Formación
del tabique transversal
del tabique transversal
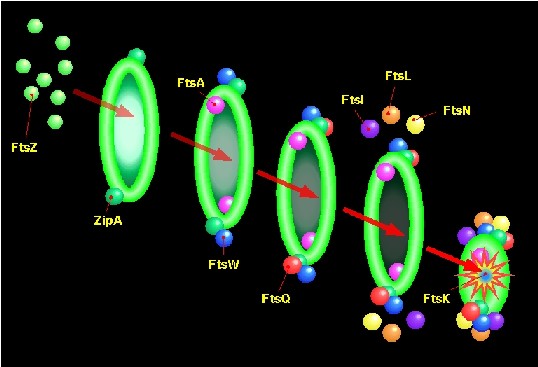
La división de la bacteria por fisión
binaria simétrica se logra por medio de una invaginación circular de las
envueltas (membrana citoplásmica y peptidoglucano) en mitad de la célula
madre. En el inicio de este proceso tiene un papel esencial la proteína FtsZ, y
más tarde intervienen otras proteínas Fts.
binaria simétrica se logra por medio de una invaginación circular de las
envueltas (membrana citoplásmica y peptidoglucano) en mitad de la célula
madre. En el inicio de este proceso tiene un papel esencial la proteína FtsZ, y
más tarde intervienen otras proteínas Fts.
FtsZ
es una proteína imprescindible, presente tanto en eubacterias como en
arqueas, que muestra parecido con las tubulinas eucarióticas. Al parecer, al
igual que las tubulinas, la FtsZ se une a GTP, con lo que se promueve su
polimerización. Bajo control del ciclo celular, la FtsZ se ensambla poco antes
de la división en el centro de la célula, formando un “anillo citocinético”
en el lado citoplásmico de la membrana celular. Existen indicios fuertes de que
la formación de este anillo de FtsZ señaliza el sitio por donde se producirá
la división y se activará el crecimiento del peptidoglucano del tabique
transversal. Una vez que FtsZ ocupa el lugar del futuro septo, entran en acción
otras proteínas Fts, formando un complejo llamado “divisoma”.
En las
fotografías a microscopio electrónico se ve cómo bajo la invaginación de
membrana que constituye la “avanzadilla” del septo, se localizan las moléculas
de FtsZ.
fotografías a microscopio electrónico se ve cómo bajo la invaginación de
membrana que constituye la “avanzadilla” del septo, se localizan las moléculas
de FtsZ.
La hipótesis señala que los polímeros
de FtsZ se van “contrayendo”, de modo que “tiran” de las envueltas hacia
el interior, provocando la típica invaginación alrededor del centro del
bacilo, y que simultáneamente, la FtsZ provoca la activación de la PBP3 (=FtsI), que es una
transglucosidasa/transpeptidasa específica del tabique transversal.
de FtsZ se van “contrayendo”, de modo que “tiran” de las envueltas hacia
el interior, provocando la típica invaginación alrededor del centro del
bacilo, y que simultáneamente, la FtsZ provoca la activación de la PBP3 (=FtsI), que es una
transglucosidasa/transpeptidasa específica del tabique transversal.
A
microscopio electrónico se observa que este tabique está formado por dos láminas
de PG (densas a los electrones) separadas entre sí por otra transparente. El
final de la división ocurre como consecuencia de la invaginación de la
membrana externa entre las dos láminas de PG.
microscopio electrónico se observa que este tabique está formado por dos láminas
de PG (densas a los electrones) separadas entre sí por otra transparente. El
final de la división ocurre como consecuencia de la invaginación de la
membrana externa entre las dos láminas de PG.
¿Cómo se
ensambla la membrana externa con relación al PG? Parece ser que esta membrana
se ensambla en buena medida por procesos espontáneos guiados por interacciones
entre el LPS y proteínas, sirviendo el PG subyacente como andamio que facilita el montaje de toda la estructura. Parece ser
que las zonas de adhesión (junturas de Bayer) son importantes para la correcta
colocación de LPS y proteínas de la membrana externa.
ensambla la membrana externa con relación al PG? Parece ser que esta membrana
se ensambla en buena medida por procesos espontáneos guiados por interacciones
entre el LPS y proteínas, sirviendo el PG subyacente como andamio que facilita el montaje de toda la estructura. Parece ser
que las zonas de adhesión (junturas de Bayer) son importantes para la correcta
colocación de LPS y proteínas de la membrana externa.
3.2
CRECIMIENTO Y SEPTACIÓN EN UNA BACTERIA GRAM-POSITIVA: Enterococcus
faecalis
A diferencia de lo visto en E. coli,
en el enterococo (Enterococcus faecalis)
el crecimiento del PG no es difuso, sino zonal,
comenzando en el centro (zona ecuatorial) y avanzando hacia afuera.
Véase en la figura el experimento de marcado de pared celular con
anticuerpos fluorescentes, con ulterior seguimiento del marcaje al microscopio:
tras unos 15 minutos después del marcado se observa que existe una banda ecuatorial oscura (no marcada, por lo tanto está constituida por material nuevo recién insertado), mientras que los polos de las células siguen enteramente marcados. | |
Tras 30 o 60 minutos observamos células enteramente sin marcar, intercaladas entre células con uno de sus polos marcados. |
El proceso se puede describir así:
1.
En la célula adulta antes de la división aparece una banda ecuatorial
donde la pared celular se hace más gruesa.
En la célula adulta antes de la división aparece una banda ecuatorial
donde la pared celular se hace más gruesa.
2.
Debajo de esta zona engrosada (hacia el interior del citoplasma) se va
depositando nuevo material, lo que marca el inicio de la formación del tabique
transversal. Enseguida aparece una muesca en la banda ecuatorial.
Debajo de esta zona engrosada (hacia el interior del citoplasma) se va
depositando nuevo material, lo que marca el inicio de la formación del tabique
transversal. Enseguida aparece una muesca en la banda ecuatorial.
3.
El tabique, con un grosor doble al de la pared celular de la superficie
celular, sigue avanzando, hasta que...
El tabique, con un grosor doble al de la pared celular de la superficie
celular, sigue avanzando, hasta que...
4.
... se completa. Simultáneamente a los pasos 3º y 4º la zona de nueva
síntesis de P.C. superficial alcanza el ecuador de las celúlas hijas
nacientes.
... se completa. Simultáneamente a los pasos 3º y 4º la zona de nueva
síntesis de P.C. superficial alcanza el ecuador de las celúlas hijas
nacientes.
5.
El tabique completo de doble grosor va siendo escindido en dos mitades
desde el exterior hacia el centro, por acción de autolisinas. De esta forma se
le adjudica a cada célula hija la nueva pared correspondiente a uno de sus
polos (el otro procede, intacto, de la célula madre).
El tabique completo de doble grosor va siendo escindido en dos mitades
desde el exterior hacia el centro, por acción de autolisinas. De esta forma se
le adjudica a cada célula hija la nueva pared correspondiente a uno de sus
polos (el otro procede, intacto, de la célula madre).
Véase igualmente la figura que
muestra en más detalle la formación del tabique. La idea que se saca del
proceso en esta bacteria es que posee una sola zona de crecimiento de PG, con
dos regiones de deposición de nuevo material: la región del tabique
transversal propiamente dicho, y la región adyacente, ya en la superficie
celular, responsable de la expansión de la pared periférica, a ambos lados del
tabique.
muestra en más detalle la formación del tabique. La idea que se saca del
proceso en esta bacteria es que posee una sola zona de crecimiento de PG, con
dos regiones de deposición de nuevo material: la región del tabique
transversal propiamente dicho, y la región adyacente, ya en la superficie
celular, responsable de la expansión de la pared periférica, a ambos lados del
tabique.
4
PROTOPLASTOS Y ESFEROPLASTOS
Mediante procedimientos de laboratario se puede lograr eliminar total o
parcialmente la pared celular bacteriana. Se denominan protoplastos
las células bacterianas a las que se ha desprovisto totalmente de pared
celular, mientras que esferoplastos
son aquellas células bacterianas que poseen restos de pared.
Obtención.
Existen dos posibles métodos alternativos:
Existen dos posibles métodos alternativos:
1.
Por destrucción del entramado del PG mediante enzimas líticas
(lisozima, peptidasas). En el caso de bacterias Gram-negativas, previamente hay
que desorganizar la membrana externa para hacerla permeable a estas enzimas.
Ello se logra usando el quelante EDTA y/o sometiendo las células a bajas
temperaturas.
Por destrucción del entramado del PG mediante enzimas líticas
(lisozima, peptidasas). En el caso de bacterias Gram-negativas, previamente hay
que desorganizar la membrana externa para hacerla permeable a estas enzimas.
Ello se logra usando el quelante EDTA y/o sometiendo las células a bajas
temperaturas.
2.
Por inhibición de la formación de nuevo PG en las células en
crecimiento, tratándolas p. ej., con penicilina. Si se parte de un mutante
auxotrofo para un componente del PG basta hacer crecer a la bacteria en un medio
carente de dicho componente.
Por inhibición de la formación de nuevo PG en las células en
crecimiento, tratándolas p. ej., con penicilina. Si se parte de un mutante
auxotrofo para un componente del PG basta hacer crecer a la bacteria en un medio
carente de dicho componente.
Estos métodos permiten:
en el caso de Gram-positivas, la desorganización total de su pared, por lo que se obtienen protoplastos; | |
en el caso de las Gram-negativas, quedan restos de membrana externa y de peptidoglucano atrapados en ella, por lo que se obtienen esferoplastos. |
En ambos casos, protoplastos y
esferoplastos pueden revertir a la forma normal eliminando el tratamiento
(retirando la lisozima, o la penicilina).
esferoplastos pueden revertir a la forma normal eliminando el tratamiento
(retirando la lisozima, o la penicilina).
 |
Los protoplastos son osmóticamente sensibles:
|
Protoplastos y esferoplastos son formas osmóticamente
sensibles debido precisamente a que al no existir o estar
desorganizado parcialmente el PG, ya no se pueden contrarrestar las fuerzas de
presión osmótica existentes en los medios hipotónicos en que normalmente se
cultivan o suspenden las bacterias. Por lo tanto, si se quieren obtener
suspensiones estables de estas formas, hay que obtenerlas en medios o soluciones
isotónicos o
ligeramente hipertónicos, para evitar su lisis:
soluciones de NaCl 0,25-0,5 M; | |
sorbitol o sacarosa 0,1-0,5 M; | |
polietilénglicol (PEG) al 7,5%. |
En estos medios los protoplastos y
esferoplastos poseen formas esféricas, independientemente de la forma que
tuviera la bacteria con pared de que proceden.
esferoplastos poseen formas esféricas, independientemente de la forma que
tuviera la bacteria con pared de que proceden.
Se emplean en varios aspectos de
investigación básica:
investigación básica:
método suave para luego obtener extractos libres de células y fracciones subcelulares. | |
en algunas bacterias, método para hacerlas permeables al ADN, en experimentos de transformación genética. | |
para realizar fusión entre protoplastos de diferentes cepas de la misma especie e incluso entre especies distintas. Se trata de un método de obtención de “recombinantes somáticos” usado para determinados estudios genéticos en bacterias que no tengan sistemas naturales de transferencia genética. |
5
FORMAS L
Son células bacterianas carentes total o casi totalmente de P.C., con
formas pleomórficas, irregulares y globulares, que se producen de forma espontánea
en algunas especies bacterianas (p. ej., Streptobacillus
moniliformis) cuando se cultivan en medios a base de suero (que son hipertónicos).
Las colonias de las formas L naturales son muy características: en
“huevo frito”, bifásicas.
Se pueden obtener de forma inducida formas L en diversas bacterias
Gram-positivas y Gram-negativas, tratándolas con penicilina en medios hipertónicos.
Las formas L inestables se generan por tratamientos breves, y pueden
revertir con frecuencia a la forma normal con pared. Poseen algo de PG, aunque
éste se encuentra alterado respecto al PG de la célula normal.
Las formas L estables se producen por tratamientos más prolongados, y no
suelen revertir al tipo normal. La mayoría carecen totalmente de
peptidoglucano.
Así pues, en las formas L el peptidoglucano ha sido eliminado total o
parcialmente, pero de manera que ya no puede servir de aceptor de nuevo PG.
BIBLIOGRAFÍA
CAPÍTULOS
DE LIBROS DE REFERENCIA
DE LIBROS DE REFERENCIA
VAZQUEZ, D. (1986): Biosíntesis del
peptidoglucano: mecanismos de acción y selectividad de los antibióticos
inhibidores. En: Bioquímica y Biología Molecular (Coordinador: L. Cornudella).
Salvat, Barcelona, págs. 133-140.
peptidoglucano: mecanismos de acción y selectividad de los antibióticos
inhibidores. En: Bioquímica y Biología Molecular (Coordinador: L. Cornudella).
Salvat, Barcelona, págs. 133-140.
WHITE,
D. (1995): “The physiology and biochemistry of Prokaryotes”. Oxford
University Press, Nueva York y Oxford. Consultar el
capítulo 10.
D. (1995): “The physiology and biochemistry of Prokaryotes”. Oxford
University Press, Nueva York y Oxford. Consultar el
capítulo 10.
ARTÍCULOS
DE REVISIÓN
DE REVISIÓN
KENNEDY, E.P. (1996): Membrane-derived
oligosaccharides. En:
“Escherichia coli and Salmonella
typhimurium. Cellular and molecular biology”, 2ª edición (F.C. Neidhart,
ed.). American Society for Microbiology Press. Washington, D.C. (1996), págs.
1064-1071.
oligosaccharides. En:
“Escherichia coli and Salmonella
typhimurium. Cellular and molecular biology”, 2ª edición (F.C. Neidhart,
ed.). American Society for Microbiology Press. Washington, D.C. (1996), págs.
1064-1071.
LUTKENHAUS,
L. (1993): FtsZ ring in bacterial cytokinesis. Mol. Microbiol. 9:
403-409.
L. (1993): FtsZ ring in bacterial cytokinesis. Mol. Microbiol. 9:
403-409.
LUTKENHAUS,
J., A. MUKHEEERJEE (1996): Cell division. En: “Escherichia coli and Salmonella
typhimurium. Cellular and molecular biology”, 2ª edición (F.C. Neidhart,
ed.). American Society for Microbiology Press. Washington, D.C. (1996), págs.
1615-1625.
J., A. MUKHEEERJEE (1996): Cell division. En: “Escherichia coli and Salmonella
typhimurium. Cellular and molecular biology”, 2ª edición (F.C. Neidhart,
ed.). American Society for Microbiology Press. Washington, D.C. (1996), págs.
1615-1625.
NANNINGA,
N. (1991): Cell division and peptidoglycan assembly in Escherichia coli. Mol. Microbiol. 5: 791.795.
N. (1991): Cell division and peptidoglycan assembly in Escherichia coli. Mol. Microbiol. 5: 791.795.
NANNINGA,
N., F.B. WIENTJES, E. MULDER, C.L. WOLDRINGH (1992): Envelope growth in Escherichia
coli. Spatial and temporal organization. En "Prokaryotic structure and
function: a new perspective. Society for General Microbiology & Cambridge
University Press, Cambridge, pp. 185-221.
N., F.B. WIENTJES, E. MULDER, C.L. WOLDRINGH (1992): Envelope growth in Escherichia
coli. Spatial and temporal organization. En "Prokaryotic structure and
function: a new perspective. Society for General Microbiology & Cambridge
University Press, Cambridge, pp. 185-221.
RAETZ,
CH.R.H. (1996) Bacterial lipopolysaccharides: a remarkable family of bioactive
macroamphiphiles. En: “Escherichia coli
and Salmonella typhimurium. Cellular
and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American Society
for Microbiology Press. Washington, D.C. (1996), págs. 1035-1063.
CH.R.H. (1996) Bacterial lipopolysaccharides: a remarkable family of bioactive
macroamphiphiles. En: “Escherichia coli
and Salmonella typhimurium. Cellular
and molecular biology”, 2ª edición (F.C. Neidhart, ed.). American Society
for Microbiology Press. Washington, D.C. (1996), págs. 1035-1063.
VAN
HEIJENOORT, J. (1996): Murein synthesis. En: “Escherichia coli and Salmonella
typhimurium. Cellular and molecular biology”, 2ª edición (F.C. Neidhart,
ed.). American Society for Microbiology Press. Washington, D.C. (1996), págs.
1025-1034.
HEIJENOORT, J. (1996): Murein synthesis. En: “Escherichia coli and Salmonella
typhimurium. Cellular and molecular biology”, 2ª edición (F.C. Neidhart,
ed.). American Society for Microbiology Press. Washington, D.C. (1996), págs.
1025-1034.
VICENTE,
M., J. ERRINGTON (1996): Struture, function and controls in microbial division.
Mol. Microbiol. 20: 1-7.
M., J. ERRINGTON (1996): Struture, function and controls in microbial division.
Mol. Microbiol. 20: 1-7.
VINELLA,
D., P. BOULOC, R. D'ARI (1993): GTPase enters the ring. Curr.
Biol. 3: 65-66.
D., P. BOULOC, R. D'ARI (1993): GTPase enters the ring. Curr.
Biol. 3: 65-66.
Actualizado el
miércoles, 15 de febrero de 2006
miércoles, 15 de febrero de 2006





No hay comentarios:
Publicar un comentario