Un estereoisómero es un isómero que tiene la misma fórmula molecular y cuadricula, también la misma secuencia de átomos enlazados, con los mismos enlaces entre sus átomos, pero difieren en la orientación tridimensional de sus átomos en el espacio.1 2 Se diferencian, por tanto, de los isómeros estructurales, en los cuales los átomos están enlazados en un orden diferente dentro de la molécula.3
Índice
Clasificación
- Isómeros conformacionales, confórmeros o rotámeros, fácilmente interconvertibles entre sí por la rotación en torno a enlaces.4
Se puede presentar en compuestos con cadenas abiertas, y en anillos. - Isómeros configuracionales, sólo interconvertibles entre sí mediante ruptura de enlaces.
- Estos, a su vez, se pueden clasificar en:
- Estereoisómeros quirales: No son superponibles con su imagen en el espejo. Pueden ser enantiómeros y diastereoisómeros.5
-
- Enantiómeros,
que son imágenes especulares no superponibles entre sí. Si una molécula
tiene un isómero especular no superponible se dice que es una molécula quiral, que posee quiralidad o que es ópticamente activa. - Diastereoisómeros o disterómeros, que son los demás estereoisómeros, los que no son enantiómeros, o sea, no son imágenes especulares entre sí.
- Enantiómeros,
- Un compuesto puede tener como máximo un enantiómero pero puede tener varios diastereoisómeros.
Ejemplo de atropoisomería en el 6,6’-dinitro-2,2’-difenilbenzoico.
-
- Estereoisómeros no quirales: Son superponibles con su imagen en el
espejo. Difieren en su mayor parte en la ordenación de los átomos en el
plano. Pueden ser formas meso, isómeros cis-trans, isómeros sin-anti, isómeros E-Z, isómeros endo-exo, e isómeros in-out.5
- Estereoisómeros no quirales: Son superponibles con su imagen en el
- Los isómeros configuracionales son aislables, ya que es necesaria una gran cantidad de energía para interconvertirlos (energía necesaria para la ruptura de enlaces), mientras que los isómeros conformacionales generalmente no son aislables, debido a la facilidad de interconversión aun a temperaturas relativamente bajas. La rama de la estereoquímica que estudia los isómeros conformacionales que son aislables (la mayoría derivados del bifenilo) se llama atropoisomería.
Isómeros conformacionales o confórmeros
Isómeros conformacionales de la molécula de etano, mostrando la diferencia de energía entre las conformaciones alternadas y eclipsada.
que tienen formas diferentes debido a las rotaciones sobre uno o más
enlaces. Las conformaciones diferentes pueden tener diferentes energías,
por lo general se pueden convertir internamente con facilidad, y son
muy raramente aislables. Por ejemplo, el ciclohexano
puede existir en una variedad de conformaciones diferentes, incluyendo
una conformación en silla y una conformación en bote, pero para el
ciclohexano, éstos isómeros nunca pueden ser separados. La conformación
en bote presenta un máximo de energía (y no es un estado de transición)
en el itinerario de transformación entre las dos formas silla
equivalentes.
Hay algunas moléculas que pueden ser aisladas en varias
conformaciones, debido a las grandes barreras de energía entre las
diferentes conformaciones. Los 2,6,2',6'-bifenilos tetrasustituidos
pueden encajar en esta última categoría.
Isómeros configuracionales
Un estereoisómero configuracional es un estereoisómero de unamolécula de referencia que tiene configuración opuesta en un
estereocentro (por ejemplo, R-vs-S o E-vs-Z).
Esto significa que los isómeros configuracionales sólo puede
interconvertirse mediante la ruptura de enlaces covalentes del
estereocentro, por ejemplo, invirtiendo las configuraciones de algunos o
de todos los estereocentros o centros quirales de un compuesto.
El número de estereoisómeros de un compuesto depende del número de centros quirales que posee. La (+)-glucosa posee cuatro carbonos asimétricos y posee, por tanto, 24 = 16 estereoisómeros. Uno de ellos, la α-D-glucosa es la unidad estructural del almidón; la β-D-glucosa, otro estereoisómero, es la unidad estructural de la celulosa. Pueden ser de dos tipos según sean o no sean imágenes especulares entre sí: enantiómeros y diastereoisómeros.
Estereoisómeros quirales
Enantiómeros
Las dos formas enantiómeras de una molécula con un carbono asimétrico.
son imágenes especulares entre sí, y no son superponibles. Las manos
humanas son un ejemplo macroscópico de estereoisomería. Todos los centros estereogénicos o estereocentros en un isómero tienen la configuración opuesta en el otro. Dos compuestos que son enantiómeros entre sí tienen las mismas propiedades físicas, a excepción de la dirección en que giran la luz polarizada.
También tienen las mismas propiedades químicas, excepto el modo en que
interactúan con diferentes isómeros ópticos de otros compuestos. Por
esta razón, los enantiómeros puros exhiben el fenómeno de la actividad óptica y pueden ser separados sólo con el uso de un agente quiral.
En la naturaleza, sólo está presente uno de los dos enantiómeros de la
mayoría de los compuestos biológicos quirales, tales como los aminoácidos (excepto la glicina, que es aquiral).
Como resultado, los diferentes enantiómeros de un compuesto pueden tener efectos biológicos muy diferentes.6 Por ejemplo, un estereoisómero de la cloromicetina es un antibiótico mientras el otro no muestra esa propiedad.
Diferentes configuraciones del ácido tartárico.
Los dos superiores son enantiómeros. Los dos inferiores son
equivalentes (forma meso). Cualquiera de las estructuras superiores es
un diastereoisómero de las estructuras inferiores. La mezcla en
proporciones iguales (1:1) de las formas dextro y levo forma un racémico
o mezcla racémica, sin actividad óptica.
Los dos superiores son enantiómeros. Los dos inferiores son
equivalentes (forma meso). Cualquiera de las estructuras superiores es
un diastereoisómero de las estructuras inferiores. La mezcla en
proporciones iguales (1:1) de las formas dextro y levo forma un racémico
o mezcla racémica, sin actividad óptica.
Isómeros de configuración absoluta R y S.
El ácido (R,R)-tartárico (o ácido L(+)-tartárico) es imagen especular
del ácido (S,S)-tartárico (o ácido D(-)-tartárico) y por tanto son
enantiómeros entre sí. Cuando el ácido tartárico se forma como producto o
subproducto entre sustancias de origen biológico, sólo obtenemos la
forma dextro.
Diastereoisómeros o diasterómeros
Los diastereoisómeros o diasterómeros sonestereoisómeros que no están relacionados a través de una operación de
reflexión. O sea, no son imágenes especulares uno del otro. Entre ellos
se incluyen los compuestos meso, los isómeros cis-trans
(E-Z), y los isómeros ópticos no enantioméricos. Los diastereoisómeros
de un compuesto rara vez tienen las mismas propiedades físicas, a
diferencia de los enantiómeros que tienen las mismas propiedades en
cualquier entorno no quiral (en ausencia de luz polarizada). Sus
propiedades químicas son similares pero no iguales.7
Estereoisómeros no quirales
Formas meso o estructuras meso
Las estructuras meso, compuestos meso o formas mesoson compuestos superponibles a su imagen especular, a pesar de poseer
centros quirales. En el ejemplo que se muestra a continuación, la forma
meso del ácido tartárico
forma un par de diastereoisómeros tanto con la forma levo o con la
forma dextro del ácido tartárico; estas últimas forman un par de
enantiómeros entre sí. Las dos estructuras meso representadas en
realidad son superponibles y forman una sola y única estructura.
 |
 |
 |
ácido tartárico (natural) ácido L-(+)-tartárico ácido dextrotartárico |
ácido D-(-)-tartárico ácido levotartárico |
ácido mesotartárico |
Mezcla (1:1) ácido DL-tartárico "ácido racémico" |
||
isómeros de arriba no significan igual que las etiquetas d- y l-,
observadas con mayor frecuencia, explicando por qué esto puede parecer
contradictorio a los que sólo conocen esta última nomenclatura. Por
favor, consulte el artículo sobre quiralidad para obtener más información acerca de las etiquetas D-y L-.
Isomería cis-trans
Isómeros cis y trans del 1,2-Dicloroeteno.
C=C porque la rotación alrededor del doble enlace está restringida,
manteniendo los sustituyentes posiciones fijas respecto a los otros. Si
los sustituyentes en un carbono del doble enlace son los mismos, entonces no existirá este tipo de isomería.
Tradicionalmente, los estereoisómeros ligados al doble enlace se notan como cis (en latín, de este lado) o trans
(del latín, cruzado), en referencia a la posición relativa de los
sustituyentes a cada lado de un doble enlace. Los ejemplos más simples
de isomería cis-trans son los etenos 1,2-disustituidos, como el 1,2-dicloroeteno (C2H2Cl2), cuyos isómeros se muestran a continuación.
Isomería E-Z
Trans-2-fluoro-3-metilpent-2-eno o bien, (Z)-2-fluoro-3-metilpent-2-eno.
trans-1,2-dicloroeteno. Debido a ocasional ambigüedad, la IUPAC ha
adoptado un sistema más riguroso en el que a los sustituyentes de cada
extremo del doble enlace se le asigna una prioridad en función de su número atómico.
Si los sustituyentes de alta prioridad están en el mismo lado del doble
enlace, al compuesto se le asigna la letra Z (del alemán, zusammen,
juntos). Si están en lados opuestos del enlace, se le asigna la letra E
(del alemán, entgegen, enfrentados). En el ejemplo anterior, el cloro
tiene un número atómico mayor que el hidrógeno, y por ello es el grupo
de mayor prioridad. Utilizando esta notación para nombrar las moléculas
anteriores, la molécula I es (Z)-1,2-dicloroeteno y la molécula II es
(E)-1,2-dicloroeteno. No siempre Z y cis (o bien, E y trans) son
intercambiables. Veamos la molécula siguiente de fluorometilpenteno:
Isómeros cis y trans del 1,2-dimetilciclopentano.
se encuentran en lados opuestos del doble enlace, o bien,
(Z)-2-fluoro-3-metilpent-2-eno, porque los grupos de mayor prioridad que
hay a cada lado del doble enlace están en el mismo lado del doble
enlace. El átomo de flúor
es el grupo de mayor prioridad en el lado izquierdo del doble enlace, y
el grupo etilo es el de mayor prioridad en el lado derecho de la
molécula.
Los términos cis y trans se usan también para describir la posición relativa de dos sustituyentes de un anillo: cis, si están del mismo lado; trans, si están en lados diferentes.
Isómeros sin y anti en compuesto con doble enlace C=N
Isomería sin-anti
Es una isomería similar a la isomería geométrica cis-trans, pero envez de doble enlace C=C, tenemos otros dobles enlaces diferentes, como
C=N; N=N o N=S.8
Es típica de iminas, oximas, azocompuestos. Se denomina sin al isómero cuyos grupos de mayor prioridad están juntos, y anti en el caso en que dichos grupos de mayor prioridad están opuestos.
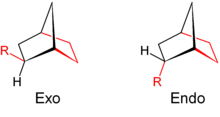
Isomería endo-exo
Isómeros endo y exo
El puente actúa como uno de los grupos. Si dejamos el puente en una
posición fija y nos fijamos en la posición del otro sustituyente, se
pueden presentar dos situaciones: que esté del mismo lado (isómero exo, que sería similar a cis), o del lado opuesto (isómero endo, similar a trans).
Isomería in-out
La isómeros in-outtambién se presenta en el caso de anillos cuando una cadena actúa como
grupo sustituyente a ambos lados. Por ejemplo en las diaminas
tricíclicas con el átomo de nitrógeno como cabeza de puente a ambos
lados y cadenas largas actuando como puente.9
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Estereoisomería.
Wikimedia Commons alberga contenido multimedia sobre Estereoisomería.
Referencias
Gold Book, Compendium of Chemical Terminology, 2ª ed. ("Gold Book")
(1997). Versión en línea corregida: (2006-) título = stereoisomerism |
fichero = S05983}}
- Isomería in-out. En: Estereoquimica. Pedro Antonio García Ruiz. EDITUM. Universidad de Murcia. Pág. 24

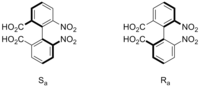








No hay comentarios:
Publicar un comentario